Transabdominale Bestimmung der fetalen Blutsauerstoffsättigung
Einleitung:
Zuverlässige Informationen über die aktuelle Blutsauerstoffsättigung der Feten unmittelbar vor und während des Geburtsprozesses bereitstellen zu können, ist ein substantieller Beitrag zur Reduzierung von Risiken für Mutter und Kind. Deshalb ist fetale Pulsoxymetrie bereits seit mehreren Jahrzehnten Gegenstand medizintechnischer Forschungsprojekte. Die Möglichkeit, die Blutsauerstoffsättigung durch das Abdomen der schwangeren Frau mit einem nichtinvasiven optischen Messverfahren ermitteln zu können, bietet ein additives diagnostisches Verfahren zur Überwachung der fetalen Vitalparameter Herzfrequenz und Blutsauerstoffsättigung.
Grundlagen:
Physiologie des Kindes
Der Blutkreislauf der Mutter ist vom Blutkreislauf des Fetus strikt getrennt. Das mütterliche Blut strömt über die utero-plazentaren Arterien in die schmalen spaltförmigen Räume zwischen den Zotten der Plazenta, die sog. intervillösen Räume [10]. Der Gas- und Nährstoffaustausch findet durch Diffusion über eine Austauschfläche von ca. 15 m2 mit einer Wandstärke von ca. 2–5 µm statt [11]. Der Sauerstoffaustausch durch Diffusion wird physikalisch durch das 1. Ficksche Diffusionsgesetz beschrieben. Der fetale Blutkreislauf besteht aus mehreren Shunt-Verbindungen, um die nicht funktionsfähige Lunge sowie Leber größtenteils umgehen zu können. Zusätzlich arbeiten beide Herzkammern parallel. Das venöse Blut aus der oberen Körperhälfte mischt sich mit dem sauerstoffreicheren Blut der unteren Körperhälfte. Demgemäß besteht die arterielle Versorgung des Fetus immer aus Mischblut. Dies hat wesentliche Auswirkungen auf die Sauerstoffsättigung des arteriellen Blutes und entsprechend auf die Messergebnisse der Pulsoxymetrie. Im Bereich der Nabelschnurvene kann die Sauerstoffsättigung bei 80 % liegen und im Bereich unterhalb der Lunge bei 65–70 % [12].
Bei einem gesunden erwachsenen Menschen liegt der prozentuale Anteil des oxygeniertem Hämoglobins zwischen 95 und 98 %. In der Plazentapassage zwischen Mutter und Fetus kann die Sättigung auf 96%-70 % absinken. Besonders bei der Geburt kann die Wehentätigkeit und der daraus resultierender Druck auf den Uterus zu einer Minderdurchblutung der Plazenta führen. Somit verringert sich auch der Sauerstoffaustausch. Zeitgleich beträgt die Sauerstoffsättigung im Bereich zwischen Zotten und Plazenta 65–75 %. Damit trotz der geringen Sättigungsdifferenz zwischen fetalen und mütterlichen Blut eine Diffusion stattfinden kann, hat das fetale Hämoglobin eine höhere Sauerstoffaffinität. Sie wird zusätzlich durch die Parameter Temperatur und pH-Wert beeinflusst. Zusätzlich verfügt der Fetus über eine höhere Hämoglobinkonzentration mit 16–24 g/dl. Ein Erwachsener besitzt nur etwa 12–16 g/dl [11]. Zusätzlich liegen beim Fetus eine erhöhte Gewebe- und Hirndurchblutung vor.
Mit dem Einsetzen der Geburt bzw. der Wehentätigkeit sinkt der fetale pH-Wert ab. Hierbei wird die fetale Pufferkapazität beansprucht und der Toleranzbereich des Fetus gegenüber einem verminderten Sauerstoffangebot sinkt. Eine weitere Ursache für eine verminderte Sauerstoffversorgung des Fetus kann eine verminderte Durchblutung der Plazenta aufgrund des Absinkens des mütterlichen Blutdrucks sein. Eine Reduzierung der plazentaren Austauschfläche oder eine Verdickung der Membran können weitere Gründe sein.
Eine Hypoxie kommt in schweren Formen mit einer Häufigkeit von ca. 1:5.000 bis 1:10.000 Geburten vor. In der Mehrzahl der Fälle kommt es zu einem folgenlosen Überleben, in 10–20 % zu einer Zerebralparese, sehr selten auch zum Tod des Fetus.
Weiterhin verfügen Feten über eine höhere Herzfrequenz als erwachsene Menschen. Die Herzrate wird in der Literatur mit einer Frequenz von 120 bis 160 Schlägen pro Minute angegeben [26]. Diese unterschiedlichen Vital-Parameter müssen bei der fetalen Pulsoxymetrie berücksichtigt werden.
Was ist eigentlich Pulsoxymetrie ?
Die Pulsoxymetrie wurde 1972 von Takou Aoyagi beschrieben und ist ein nicht invasives Messverfahren zur Bestimmung der arteriellen Blutsauerstoffsättigung. Dabei wird sich die Eigenschaft von Blut zunutze gemacht, nach der oxygeniertes und desoxygeniertes Hämoglobin bei Licht in einem Wellenlängenbereich von 600 nm – 1000 nm ein unterschiedliches Absorptionskoeffizienten aufweisen. Die Pulsoxymetrie vereint zwei physikalische Messverfahren [14]. Die Plethysmografie sowie die spektralfotometrische Oxymetrie. Heute findet man die Pulsoxymetrie in der Anästhesiologie, der Notfall- und Intensivmedizin, der Schlafforschung sowie in vielen anderen medizinischen Teilgebieten.
Bei der Plethysmografie handelt es sich um ein Messverfahren zur Bestimmung der Volumenänderungen eines Körperteils oder Organs. Sie ermöglicht es die pulsierenden Komponenten aus dem zu untersuchendem Gewebe genauer betrachten zu können. Bei der pulsierenden Komponente handelt es sich um das arterielle Blut, welches zum Zeitpunkt der Systole durch die Arterien gepumpt wird. Die nicht pulsierenden Komponenten bestehen unter anderem aus venösem Blut, Kapillarblut, Knochen, Haut und Weichgewebe. Um die arterielle Sauerstoffsättigung bestimmen zu können, nutzt man die Unterschiede der Absorptionsmuster in der Systole und der Diastole. In der Systole strömt Blut in die Arterien und weitet die Kapillargefäße unter der Haut. Durch den Volumenanstieg steigt auch die Hämoglobinkonzentration und die Lichtabsorption nimmt zu. Zusätzlich ist das Volumen, welches das Licht in der Systole zu durchdringen hat, größer als in der Diastole. Die Absorption nimmt in der Systole zu und in der Diastole ab. Wird die Absorption kontinuierlich gemessen, so verändert sie sich in Abhängigkeit von der Pulskurve. Wird nun die Differenz der Absorption in Systole und Diastole berechnet, so erhält man die reine Absorption des fließenden Blutes. Unter der Annahme, dass oxygeniertes und desoxygeniertes Hämoglobin die einzigen Absorber in dem systolischen Zusatzvolumen darstellen, kann auf der Basis der Messung bei zwei verschiedenen Wellenlängen die funktionelle Sättigung errechnet werden. Die spektralphotometrische Oxymetrie basiert auf der Ermittlung der Sauerstoffsättigung des arteriellen Blutes anhand der verschiedenen Absorptionsspektren von oxygenierten und desoxygenierten Hämoglobin. Hierfür wird das Gewebe von Licht zweier verschiedener Spektralbereiche durchleuchtet. Dazu wird rotes Licht im Bereich von 660 nm - 760 nm und infrarotes Licht im Bereich von 810 nm - 940 nm verwendet.
Oxigeniertes und desoxigeniertes Hämoglobin haben im Bereich von 600 nm – 1000 nm ein unterschiedliches Absorptionsspektrum. Um den Anteil des oxygenierten Blutes an der gesamten Blutmenge zu bestimmen, benötigt man zwei verschiedene Wellenlängen, welche oberhalb und unterhalb des isobestischem Punkt liegen. Der isobestische Punkt kennzeichnet die Stelle, an der die Absorptionskoeffizienten keine Abhängigkeit von der Sauerstoffsättigung aufweisen. [16]
Technisch wird die Blutsauerstoffmessung mit einem Sensor, bestehend aus zwei LEDs mit verschiedenen Wellenlängen und einigen Photodioden, umgesetzt. Der Sensor wird an einer gut durchbluteten Extremität appliziert und die transmittierte Lichtintensität wird gemessen. Die Photodioden wandeln die Lichtintensität in ein proportionales Stromsignal um. In einer elektrischen Schaltung wird das Stromsignal in einem Strom-Spannungswandler in eine Spannung umgewandelt. Anschließend werden die Spannungswerte über einen A/D-Wandler digitalisiert. Die weitere Datenverarbeitung und die Berechnung der Blutsauerstoffsättigung findet anschließend am Computer statt.
Charakteristik der Pulswelle
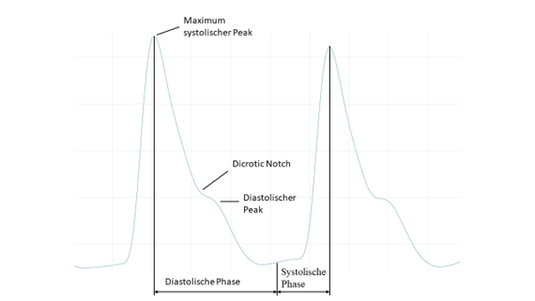
Die Abbildung zeigt den genauen Verlauf einer Pulswelle während einer Pulsoxymetrischen Messung. Während der systolischen Phase kontrahiert der Herzmuskel, das Blut wird in die Arterien gedrückt und die Absorption im Messbereich nimmt zu. Nach Überschreiten des systolischen Maximums beginnt die diastolische Phase, in welcher sich der Herzmuskel entspannt und die Absorption im Messbereich reduziert wird. Während der diastolischen Phase lässt sich im Pulswellenverlauf ein zweiter Peak erkennen. Dieser Peak wird Dircotic Notch oder dikrotische Kerbe genannt und entsteht durch die Reflexion der Pulswelle in der Peripherie der Arterien. Der Gefäßdurchmesser in den Arteriolen am Ende der Arterien wird geringer. Durch diese Impedanzveränderung entsteht an diesen Abzweigungen eine Reflexion der Pulswelle. Diese invertierte „diastolische Pulswelle“ sorgt für den nicht kontinuierlichen Strom- bzw. Blutfluss. Zu beachten ist hier, dass es eine Verzögerung zwischen dem Kontrahieren des Herzmuskels und einem Blutvolumenantieg in der Peripehrie der Finger gibt. Durch die Kontraktion der Ventrikel wird zum einen eine Blutsäule transportiert und zum anderen eine Druckwelle erzeugt, welche sich mit einer Geschwindigkeit von 5–15 m/s entlang der Gefäße bewegt [31].
Die Pulswellengeschwindigkeit wird in der Literatur im Bereich der Aorta mit 3–5 m/s angegeben. Die PWV erhöht sich mit steigender Gefäßverengung sowie abnehmender Elastizität. Somit steigt die PWV in der Peripherie auf eine Geschwindigkeit zwischen 5 und 10 m/s [33].
Störeinflüsse bei der Pulsoxymetrie
Unabhängig, ob es sich bei der Pulsoxymetrie um eine Messung bei einem erwachsenen Menschen oder einem ungeborenen Fötus handelt, können Störeinflüsse das Nutzsignal beeinflussen oder überlagern. Die am häufigsten auftretenden Limitierungen bei der Messung der Blutsauerstoffsättigung werden im Folgenden näher erläutert.
Shuntlicht
Als Shuntlicht wird das Umgebungslicht bezeichnet, welches von außen auf die Empfängereinheit einstrahlt. Dabei kann das Spektrum des Umgebungslichtes auch Wellenlängen beinhalten, mit welchen die Blutsauerstoffsättigung gemessen wird. Diese zusätzliche Lichtintensität, die auf die Photodioden der Empfängereinheit trifft, sorgt für eine höhere Amplitude im Messsignal. Somit wird bei ausreichend hohem Shuntlicht eine falsch-niedrige Sauerstoffsättigung gemessen und die Messung unbrauchbar. Aus diesem Grund muss die Empfängereinheit und der Messaufbau so effektiv wie möglich von äußerem Lichteinfall abgeschirmt werden [36].
Bewegungsartefakte
Bewegungsartefakte werden durch eine Relativbewegung zwischen Patient und Sensor erzeugt. Diese können sowohl bewusst, durch Eigenbewegung des Patienten, als auch passiv durch den Transport des Patienten entstehen. Bei dem vorliegendem Anwendungsbeispiel einer schwangeren Frau ist es praktisch unmöglich zu verhindern, dass das ungeborene Kind durch zufällige Bewegungen das Messsignal verfälscht. Eine Reduzierung der Störgröße kann jedoch bei der Signalverarbeitung durch Filterung von niederfrequenten Störanteilen erreicht werden [36].
Sensorpositionierung
Bei herkömmlichen Anwendungsbeispielen spielt die Sensorpositionierung keine besondere Rolle, solang das zu untersuchende Gewebe gut durchblutet und leicht zugänglich ist. Da bei der transabdominalen Pulsoxymetrie jedoch ein deutlich längerer und nicht homogener Strahlengang vorliegt, ist die Positionierung der Empfängereinheit von elementarer Bedeutung für die Intensität des Messsignals. Um die Signalintensität verbessern zu können, beinhaltet die Empfängereinheit 16 versetzt angeordnete Photodioden.
Physiologische Eigenschaften
Eine nicht zu vernachlässigende Limitierung, welche besonders bei der fetalen Pulsoxymetrie auftreten kann, sind optischen Eigenschaften des Fetus. Da Feten bereits zum Zeitpunkt der Geburt über dunkle Haare verfügen können, kann die pulsoxymetrische Messung hier beeinträchtigt werden. Diese Limitierung kann mit einer Repositionierung der Hardware reduziert werden. Jedoch wird immer eine erhöhte Absorption gemessen werden.
Carboxy- und Methämoglobin
Eine weitere Limitierung, welche sowohl auf die normale Pulsoxymetrie als auch auf die fetale Pulsoxymetrie zutrifft, ist die Problematik, dass mit zwei unterschiedlichen Wellenlängen auch nur zwei Hämoglobininformationen detektiert werden können. In der Realität besteht das Blut jedoch aus weiteren Hämoglobinarten wie Methämoglobin (MetHb) oder Carboxyhämoglobin (COHb). Diese dysfunktionellen Hämoglobinarten können mit Messgeräten, welche nur zwei Wellenlängen verwenden, nicht detektiert werden. Daher werden CO-Oxymeter im klinischen Kontext vermehrt eingesetzt. Sie verwenden vier oder mehr Wellenlängen, um die sogenannte fraktionelle Blutsauerstoffsättigung errechnen zu können. Dysfunktionelle Hämoglobinarten werden besonders bei Personen mit Verbrennungserscheinungen vermutet, bei denen eine Kohlenmonoxidvergiftung angenommen werden kann [24,36].
Fetale transabdominale Pulsoxymetrie
Bei der Detektion von pathologischen Herzfrequenzen des Fetus, bietet die fetale Pulsoxymetrie eine zusätzliche Methode zur Überwachung der Vitalparameter an. Bereits seit Anfang der 2000er-Jahre existierende fetale Pulsoxymeter (sog. transvaginale Pulsoxymeter) können lediglich während der Geburt verwendet werden und erfordern eine zervikale Dilatation von mindestens 2 cm und eine Ruptur der Membran. Daher bietet sich die transabdominale fetale Pulsoxymetrie als ergänzendes diagnostisches Verfahren an. Hierbei wird der Patientin eine Sendeeinheit auf den Bauch gelegt, welche in der Lage ist, hochintensive Lichtimpulse in das Abdomen zu applizieren. Hierfür werden Lichtwellenlängen im Bereich von 700 nm – 910 nm verwendet. Wellenlängen im Bereich von 600 nm – 690 nm, wie sie bei der konventionellen Pulsoxymetrie verwendet werden, verfügen über eine geringere Eindringtiefe als höhere Wellenlängen.
Die transabdominale, fetale Pulsoxymetrie ist keine Transmissions-Pulsoxymetrie. Das applizierte Licht durchdringt das mütterliche Gewebe, das Fruchtwasser und einen Teil des fetalen Gewebes. Im Idealfall werden 100 % des einfallenden Lichts an der Schädeldecke des Fetus reflektiert und treffen anschließend auf die Empfängereinheit. Der Empfänger besteht in der Regel aus einer Fläche, welche mit mehreren Photodioden besetzt ist, um ein bestmögliches Nutzsignal detektieren zu können. Bei der Auswahl der Lichtwellenlänge muss zum einen eine hohe Eindringtiefe berücksichtigt werden und zum anderen, die physikalischen Wechselwirkungen zwischen den Photonen und dem Fruchtwasser betrachtet werden. Licht weist mit einer Wellenlänge oberhalb von 1000 nm ein deutlich erhöhtes Absorptionsverhalten in Wasser und infolgedessen auch in der amniotischen Flüssigkeit auf. Der dargestellte Graph bildet die Absorptionskoeffizienten in der Einheit mm-1 bezogen auf die Wellenlänge angegeben in µm ab.
Die größte Herausforderung der transabdominalen fetalen Pulsoxymetrie liegt in der Extraktion des fetalen PPGs aus dem überlagerten Messsignal. Da die gemessene Lichtintensität sowohl das fetale als auch das parentale Gewebe durchstrahlt, befindet, sich im Messsignal ein dominanter pulsierender Anteil, welcher dem Herzschlag der Mutter zugeordnet werden kann und einen schwächeren pulsierenden Anteil, welcher dem ungeborenen Kind zugeordnet werden muss. Die Frequenz des mütterlichen Signals liegt bei ca. 60 – 90 Schlägen pro Minute, wohingegen das fetale Herz mit einer Frequenz von 120 bis 160 Schlägen pro Minute schlägt [26]. Dieser Unterschied in den Frequenzen kann als Grundlage genommen werden, das gemischte Signal in seine Bestandteile aufzuteilen und das fetale PPG zu extrahieren.
Stand von Wissenschaft und Technik (2021)
Das Konzept der Pulsoxymetrie auf Grundlage der Messung der Absorptionen von optischem Licht existiert bereits seit den 1970er-Jahren und ist fester Bestandteil der modernen Medizin geworden. Seit ca. 20 Jahren rückt das Feld der fetalen Pulsoxymetrie immer weiter in den Vordergrund der Forschung. Im Besonderen die transabdominale Pulsoxymetrie. Die technische Grundlage der transabdominalen Pulsoxymetrie ist bei den meisten wissenschaftlichen Veröffentlichungen gleich. Alle Messergebnisse werden basierend auf den bereits erläuterten physikalischen Grundlagen der Plethysmographie sowie die spektralphotometrische Oxymetrie generiert. Die größte Herausforderung in der transabdominalen Pulsoxymetrie ist die Extraktion des fetalen PPGs aus dem gemischten Messsignal. Hierfür wurden in verschiedenen Studien und Veröffentlichungen der letzten zwei Jahrzehnten verschiedene Ansätze vorgestellt, von denen einige im folgenden Absatz kurz erläutert werden.
Eine Veröffentlichung aus dem Jahr 2005 beschreibt erste Versuche transabdominal die fetale Blutsauerstoffsättigung bestimmen zu können [25]. Hierbei wurden Wellenlängen im Nahinfrarot-Bereich verwendet (735 – 850 nm). Die Sende und Empfängereinheit wurden abhängig von der fetalen Tiefe in einem Abstand von 7 bis 11 cm auf den Abdomen der schwangeren Frauen appliziert. Die aufgezeichneten Messsignale wurden während der weiteren Signalverarbeitung durch die Fourier-Transformation in den Frequenzbereich übertragen und mit dem fetalen Herzschlag, gemessen mit Ultraschall, verglichen. Anschließend wurden alle Frequenzen unterhalb der fetalen Herzrate mit Hochpassfiltern eliminiert. Die somit erhaltenen Ergebnisse ähnelten den transvaginal gemessenen Ergebnissen.
Eine weitere Studie aus dem Jahr 2009 verfolgte den Ansatz des adaptiv noise cancellation, um das fetale Signal aus dem gemischten Messsignal extrahieren zu können, [22,23]. Zusätzlich wurde die Photonenbewegung im mütterlichen sowie fetalen Gewebe simuliert, um einen optimierten Sender-Empfänger-Abstand bestimmen zu können, [27]. Das Ergebnis der Simulation von 2 Millionen Photonen mit einer Bestrahlungsintensität von 1 mW ergab einen optimalen Abstand zwischen Sender und Empfänger von 3 bis 4 cm. Das Messsignal wurde anschließend von einem adaptive noise cancelation Filter unter der Verwendung eines reversed least squares Algorithmus verarbeitet. Das somit extrahierte PPG-Signal hatte eine deutlich bessere Signalqualität als vorangegangene Studien.
Ein weiterer Ansatz zur Trennung der Signalkomponenten ist das QRS-Triggered-Averaging [28]. Grundlage für dieses 2019 veröffentlichte Verfahren bietet das bereits aus der Neurowissenschaft bekannte Spiketriggred Averaging [29]. Das QRS-Triggered Averaging verwendet die R-Zacke des EKG-Signals, um den Zeitpunkt des mütterlichen Herzschlages bestimmen zu können. Anschließend wird zu diesem Zeitpunkt das mütterliche Signal aus dem gemischten Signal subtrahiert.
Quellen
[10] Thews, G., Vaupel, P. (2001). Vegetative Physiologie (4.Auflage) Springer-Verlag Berlin Heidelberg GmbH
[11] Heß, C. (2006). Der Einfluss einer modifizierten Gebärmutterhaltung auf die pulsoxymetrisch gemessene Sauerstoffsättigung des Feten. Marburg
[12] Kranke, P. (2018) Die geburtshilfliche Anästhesie. (1.Auflage) Springer Verlag
[14] Aoyagi, T. (2003). Pulseoximetry: its invention, theory, and future. J Anesth 17(4):259-66.
[16] Kramme, R (2017). Medizintechnik: Verfahren - Systeme - Informationsverarbeitung. (5. Auflage) Springer Berlin Heidelberg
[22] Medizinproduktegesetz, Bundesministerium für Justiz und für Verbraucherschutz. Abgerufen am 28.02.2021 unter: (https://www.gesetze-im-internet.de/mpg/)
[23] C. Fischer, Kontinuierliche nichtinvasive Bestimmung des nächtlichen Blutdruckverlaufs unter Verwendung von photoplethysmograpischen Pulswellensignalen. Medizinischen Fakultät Charité – Universitätsmedizin Berlin (2019)
[24] Firma Nellcor Puritan Bennett Inc. (1997) Grundlagen der Pulsoximetrie. Firmenschrift
[25] Vintzileos, A., Nioka, S., Lake, M., Li, P., Luo, Q., Chance, B. (2005) Transabdominal fetal pulse oximetry with near-infrared spectroscopy. American Journal of Obstetrics and Gynecology 192, 129-33
[26] Pildner v. Steinburg, S., Boulesteix, A.-L., Lederer, C., Grunow, S., Schiermeier, S., Hatzmann, W., Schneider, K.-T.-M., Daumer, M. (Jun. 2013) What is the “normal” fetal heart rate?, in PeerJ 1-82
[27] A. Zourabian, B. Chance, N. Ramanujam, R. Martha, and A. B. David, (2000) “Trans-abdominal monitoring of fetal arterial blood oxygenation using pulse oximetry,” J. Biomed. Opt., no. 5, pp. 391–405,
[28] M. Schubert , F. Samann and T. Schanze (2020) QRS triggered averaging for superimposed PPG separation. Automation in Medical Engineering 2020
[29] Eckhorn, R., Obermueller, A., (1993) Single neurons are differently involved in stimulus-specific oscillations in cat visual cortex, Exp Brain Res 95:177-182.
[31] Weber, T., (2010) Grundlagen: Zentraler Blutdruck Pulswellenreflexion Pulswellengeschwindigkeit. Journal of Hypertension 14 (2), 9-13
[33] Domnich, A.; (2019): Methode zur Bestimmung des Gefäßverengungsgrades aus der Pulswellencharakteristik am Beispiel implantierbarer Sensorik für den Stent. Universität Stuttgart.
[36] Klug, N. (2014) Mobile Pulsoxymetrie. Technische Universität München.